
تقنية خلايا iPS الجذعية اليابانية على أعتاب ثورة مع تحولها إلى التطبيقات السريرية
علوم تكنولوجيا- English
- 日本語
- 简体字
- 繁體字
- Français
- Español
- العربية
- Русский
منذ أن نجح ياماناكا شينيا الحاصل على جائزة نوبل في تخليق أول خلايا جذعية بشرية مستحثة متعددة القدرات iPS في عام 2006، انشغل المجتمع الطبي بالحديث عن الإمكانيات العلاجية لهذه التقنية. وباستخدام طريقة ياماناكا، يمكن إعادة برمجة خلايا من عينات صغيرة من الجلد أو الدم وزراعتها لتخليق عدد كبير من الخلايا الجذعية القادرة على التمايز إلى خلايا متخصصة تشكل أعضاء مثل العضلات والعظام والقلب والكبد والأوعية الدموية والأعصاب.
في حين أن الكثير من الإثارة فيما يتعلق بالتطبيقات السريرية لهذه الطريقة تركز حول الطب التجديدي، أدرك ياماناكا – الذي يترأس مركز أبحاث وتطبيق خلايا iPS واختصارا ’’CiRA‘‘ التابع لجامعة كيوتو – بسرعة الدور الكامن لخلايا iPS في تطوير الأدوية. ففي شهر سبتمبر/أيلول من العام الجاري وصل مركزCiRA إلى مرحلة مهمة كبيرة مع بدء أول تجربة سريرية في العالم على دواء محتمل تم تحديده من خلال دراسة وفحص خلايا iPS.
تصاعد آمال ضحايا الأمراض النادرة
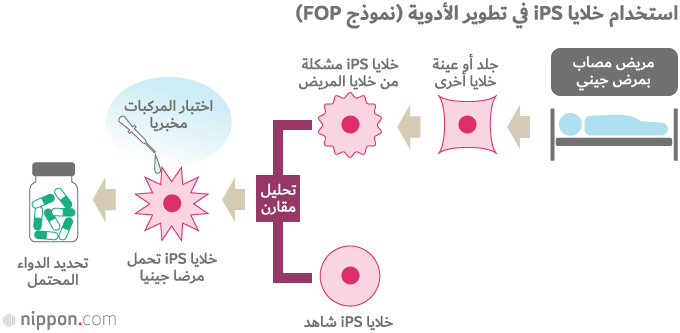
من المقرر أن تختبر التجارب السريرية التي يقودها نائب رئيس معهد CiRA توغوتشيدا جونيا فعالية دواء حالي حاصل على موافقة مسبقة لأغراض أخرى، مثل علاج خلل التنسج الليفي المتعظم المترقي أو اختصارا ’’FOP‘‘. وهذا الخلل هو اضطراب وراثي خطير ونادر تتصلب فيه الأنسجة الضامة (العضلات، الأوتار، الأربطة) تدريجيا لتصبح عظاما. وتسبب عملية التعظم تلك التي تبدأ منذ مرحلة الطفولة، فقدان القدرة على الحركة بالإضافة إلى صعوبات في الأكل والتنفس تؤدي في نهاية المطاف إلى الوفاة. وعلى الرغم من أن العلماء حددوا الطفرة الجينية المسؤولة عن هذا المرض إلا أنه لا يوجد حاليا دواء له أو علاج مصادق عليه.
وعلى الرغم من أن المرض يصيب شخصا من بين كل مليوني شخص في العالم، يبلغ عدد مرضى FOP في اليابان 80 مريضا حاليا، وهذا المرض محدد بأنه مرض عضال مستحق لتمويل الحكومة اليابانية بموجب نظام خاص لدعم دراسات وعلاج أمراض نادرة.
بدأ فريق توغوتشيدا بإعادة برمجة خلايا iPS بنجاح من خلايا مرضى مصابين بـFOP. وبمقارنة تلك الخلايا مع خلايا iPS شاهد خالية من طفرات مرض FOP، وجد الباحثون أن خلايا FOP تظهر قدرة أكبر بكثير على تشكيل العظام وحدوث ترسبات معدنية في التجربة المخبرية، واستطاعوا تحديد مسارات حيوية رئيسية في آلية التشكل الشاذ للعظام. وبهذه الطريقة، قاموا بصنع ’’نموذج عن المرض في طبق مخبري‘‘ بدون الحاجة لاستخدام نماذج من حيوانات مخبرية. وباستخدام خلايا iPS لفحص فعالية نحو 6.8 ألف مركب، وجد الباحثون أن المثبط المناعي ’’رابامايسين‘‘ يمنع التشكل الشاذ للعظام.
من المقرر أن تُجرى التجارب السريرية على رابامايسين باعتباره دواء لمرض FOP في مستشفيات تابعة لجامعات كيوتو وكيوشو وناغويا وطوكيو. وسيتم تقسيم 20 مريضا تبلغ أعمارهم 6 سنوات فما فوق، إلى مجموعتين إحداهما سيتلقى المرضى فيها عقار رابامايسين لأكثر من 6 أشهر.
يستخدم رابامايسين حاليا في أوروبا للحيلولة دون حدوث رفض مناعي للأعضاء المزروعة. أما في اليابان فتمت الموافقة عليه كعلاج لمرض ’’الورام العضلي الأملس الوعائي اللمفاوي‘‘ وأمراض مستعصية نادرة أخرى في عام 2014. إن تحديد تطبيقات جديدة لعقار رابامايسين هو مثال على ’’إعادة توصيف الدواء‘‘. وعملية إعادة تحديد استخدامات دواء ما تم اختباره والموافقة عليه بالفعل، تختصر بشكل كبير مخاطر ظهور تأثيرات جانبية خطيرة خلال التجارب السريرية. ولذلك فهي أقل تكلفة بكثير من العملية التقليدية لاستكشاف وتطوير الأدوية نظرا لأن اختبار الأمان والحركية الدوائية على البشر قد أنجز بالفعل.
وعلى الرغم من ذلك، إلا أن تكلفة التجارب السريرية تبلغ عشرات ملايين الينات، وفي حالة الأمراض النادرة مثل FOP، فإن السوق صغيرة جدا لجذب اهتمام شركات الدواء من الناحية التجارية. ولهذا السبب تمول الحكومة الآن الأبحاث والتجارب السريرية اللازمة لاختبار أدوية موجودة بالفعل لعلاج أمراض نادرة ومستعصية.
نحو عصر جديد من تطوير الأدوية
من الأمثلة الأخرى على استخدام خلايا iPS مأخوذة من مرضى يعانون من أمراض خاصة، الأبحاث السريرية التي تتم على مرض التصلب الجانبي الضُّمورِيّ أو اختصارا ’’ALS‘‘ بقيادة البروفيسور أوكانو هيدييوكي من جامعة كييو. ومن خلال إجراء فحوصات تستند إلى خلايا iPS تمكن فريق أوكانو من تحديد دواء محتمل لعلاج هذا المرض القاتل، والذي يدمر تدريجيا خلايا الأعصاب الحركية حتى يصبح المرضى غير قادرين على الحركة أو الكلام أو التنفس. ومن المتوقع أن تبدأ التجارب السريرية خلال عام 2018.
كما اكتشف الباحثون في فريق أوكانو أن عقار الرابامايسين بإمكانه تثبيط تدمير خلايا الأذن الداخلية في متلازمة بيندريد، وهي سبب شائع لحدوث فقدان السمع الوراثي. ووجد فريق بحثي يعمل تحت إشراف البروفيسور فوكودا كيئيتشي من جامعة كييو أن دواء مستخدما حاليا لعلاج فرط ضغط الدم الرئوي يشكل أيضا علاجا واعدا لاعتلال عضلة القلب الضخامي الذي تحدث فيه ثخانة وراثية في عضلة القلب ما يقود إلى حدوث فشل قلبي.
وبالعودة إلى مركز CiRA، استخدم الفريق البحثي للبروفيسور تسوماكي نورييوكي تقنية خلايا iPS لتحديد دواء محتمل لعلاج مرضين نادرين مستعصيين يصيبان الهيكل العظمي. فقد وجدوا أن أدوية الستاتينات المستخدمة بالفعل في أنحاء العالم لتخفيض مستويات الكوليسترول لها تأثير إيجابي على تشكل الغضاريف والعظام في حالة الوَدانَة – أحد مسببات القزامة – وخلل التنسج المميت، وهو اضطراب قاتل يصيب الهيكل العظمي.
آفاق الطب التجديدي
يتجلى التطبيق السريري الآخر الرئيسي المحتمل لخلايا iPS في الطب التجديدي، والذي يتم فيه استخدام خلايا جذعية لتحل مكان أنسجة متضررة أو لتجديدها. يترأس الدكتور تاكاهاشي ماسايو من مركز علم الأحياء الإنمائي التابع لمعهد ريكين منذ عام 2013 دراسة سريرية حول استخدام عصبونات شبكية متمايزة من خلايا iPS لمعالجة ’’التنكس البقعي المرتبط بالشيخوخة‘‘، وهو سبب شائع للعمى بين كبار السن. في غضون ذلك، يعكف البروفيسور ساوا يوشيكي من جامعة أوساكا (وهو رئيس الجمعية اليابانية للطب التجديدي) مع فريقه على استكشاف علاج للمرضى الذين يعانون من فشل قلبي متقدم من خلال تطعيم صفائح خلوية من خلايا عضلية قلبية مصنوعة من iPS، وذلك في إطار مشروع مشترك مع شركة تصنيع المعدات الطبية تيرمو. ومن المتوقع أن تنطلق التجارب السريرية عما قريب.
كما يستعد أوكانو من جامعة كييو (الذي يترأس فريقا بحثيا لتطوير دواء لمرض ALS) للقيام بتجارب سريرية حول إجراء جديد لزراعة آمنة لخلايا جذعية/سلفية عصبية متمايزة من خلايا iPS في مرضى يعانون من إصابات في الحبل الشوكي. وفي شهر أغسطس/آب من العام الجاري، نشر فريق بقيادة البروفيسور تاكاهاشي جون من مركزCiRA تقريرا يفيد بأن القردة أظهرت تراجعا كبيرا في الارتعاشات وأعراض مرض باركينسون الأخرى بعد خضوعها لزراعة خلايا عصبية محضرة من خلايا iPS بشرية. وبشكل عام يعتبر التأكد من فعالية العلاج وأمانه عند الثدييات العليا غير الإنسان، الخطوة الأخيرة قبل إجراء تجارب سريرية على البشر، الأمر الذي يأمل تاكاهاشي البدء به خلال عام 2018.
يتمثل الهدف النهائي من الطب التجديدي المستند إلى خلايا iPS في تخليق أعضاء بشرية كاملة بهدف الزراعة. ويتوقع الدكتور ساوا أن تصبح العلوم الطبية في غضون العقود الثلاث القادمة قادرة على تنمية قلوب بشرية والتي تعمل وفق آلية بسيطة نسبيا للتقلص العضلي.
بدأ مركز CiRA في عام 2013 ببناء وحفظ مخزونات من خلايا iPS للاستخدام في الطب التجديدي. يتم تصنيف خلايا iPS التي تتم إعادة برمجتها من خلايا النسيج المتبرع به، طبقا لنوع مستضد الكريات البيضاء البشرية لتقليل الرفض المناعي. وبحلول نهاية السنة المالية 2017، سيكون المركز قد جمع عددا كافيا من خطوط خلوية من خلايا iPS لتغطي 30% من تعداد اليابانيين. وقد قام هذا البنك بالفعل بتزويد خلايا إلى فرق بحثية منخرطة في المشروع المذكور أعلاه المتعلق بالتنكس البقعي المرتبط بالشيخوخة واستخدام صفائح خلوية لتجديد نسيج عضلة القلب.
لا تزال هناك عقبات كبرى تعترض الاستخدام الواسع لخلايا iPS في الطب التجديدي من بينها التمايز إلى أنسجة بشرية كاملة، وتحسين جودة الخلايا وفوق كل ذلك منع نمو أورام من الخلايا المزروعة. وبالاستناد إلى الإنجازات الإبداعية التي حققها ياماناكا وعلماء رواد آخرون في هذا المجال، يعمل الباحثون في الدراسات السريرية في أنحاء اليابان للتغلب على تلك التحديات ولتفجير الطاقات الكامنة الغير محدودة على ما يبدو لطريقة خلايا iPS.
(المقالة الأصلية منشورة باللغة اليابانية بتاريخ 12 أكتوبر/تشرين الثاني 2017. الترجمة من الإنكليزية. صورة العنوان: البروفيسور ساوا يوشيكي من جامعة أوساكا يعلن عن تقديمه خطة لإجراء دراسة سريرية حول استخدام خلايا مشكلة من خلايا iPS لعلاج فشل القلب بتاريخ 21 يوليو/تموز 2017. جيجي برس)