
Centro de investigación de células iPS oriundo de Japón
Ciencia Tecnología- English
- 日本語
- 简体字
- 繁體字
- Français
- Español
- العربية
- Русский
Lo más avanzado en investigación sobre células madre
Las células madre de pluripotencia inducida (iPS, por sus siglas en inglés) fueron desarrolladas en 2006, por primera vez en el mundo, por el profesor Yamanaka Shin’ya de la Universidad de Kioto. Estas nuevas células representaron un importante avance en la investigación con células madre, y tienen un enorme potencial terapéutico. Las células iPS se obtienen a partir de la manipulación genética. Mediante la inserción de cuatro genes específicos en una pequeña muestra de células epiteliales es posible convertir esas células epiteliales en células con una forma completamente distinta y generarlas casi indefinidamente. Las células creadas de esta forma pueden convertirse en cualquier tipo de célula u órgano, como por ejemplo células de hueso, corazón, nervio, hígado y sangre.
 Laboratorio abierto situado en el tercer piso del edificio de CiRA. Aquí se llevan a cabo diariamente investigaciones interdisciplinarias en un entorno de investigación completamente abierto (Foto: CiRA, Universidad de Kioto, junio de 2010).
Laboratorio abierto situado en el tercer piso del edificio de CiRA. Aquí se llevan a cabo diariamente investigaciones interdisciplinarias en un entorno de investigación completamente abierto (Foto: CiRA, Universidad de Kioto, junio de 2010).
Lo que hace únicas a las células iPS es su capacidad de generarse casi indefinidamente y convertirse en cualquier tipo de célula. El mecanismo es el mismo que cuando un huevo fecundado se divide y produce distintas células y órganos, o cuando la piel o los vasos sanguíneos se regeneran después de una herida. Las células madre inducidas artificialmente tienen la capacidad de mutar en otras células y llegar a convertirse en distintas células y órganos a través de la división y la reproducción.
Las células madre embrionarias (ES, por sus siglas en inglés) tienen las mismas propiedades. Pero con las células ES entran en juego cuestiones éticas, ya que es necesario extraerlas de embriones humanos. En cambio, las células iPS pueden generarse a partir de células somáticas adultas (un término general para las células, a excepción de las células germinales), y por ello son mucho menos problemáticas desde un punto de vista ético. La sencilla y eficaz técnica del profesor Yamanaka crea células iPS convirtiendo células somáticas en células pluripotentes. De momento, se están llevando a cabo trabajos para superar problemas como el rechazo inmunitario y la formación de tumores después del transplante de células iPS. Si se consigue superar estos problemas y se confirma que las células iPS pueden utilizarse con seguridad, estas células podrían llegar a utilizarse en una amplia gama de aplicaciones clínicas.
La aplicación más prometedora la encontramos en el campo de la medicina regenerativa. Si, por ejemplo, una persona tiene una cardiopatía grave, se podrían utilizar células iPS creadas a partir de su propia piel para inducirlas a dividirse y crear cardiomiocitos que a continuación podrían transplantarse al corazón del paciente. La posibilidad de rechazo en este caso sería mínima, dado que el injerto se realiza utilizando las propias células del paciente. Las células iPS también podrían utilizarse para crear células u órganos con síntomas a imitación de distintas enfermedades incurables. Esto podría permitir avances para dilucidar las causas de estas enfermedades y desarrollar tratamientos farmacológicos efectivos.
Plaquetas a partir de células iPS humanas
El Centro de Investigación y Aplicación de Células iPS (CiRA, por sus siglas en inglés) de la Universidad de Kioto tiene cuatro departamentos de investigación: el Departamento de Ciencia de Reprogramación, el Departamento de Cultivo y Diferenciación de Células, el Departamento de Aplicaciones Clínicas y el Departamento de Tecnología Celular Fundamental. En el laboratorio del profesor Etō Kōji del Departamento de Aplicaciones Clínicas la actividad de investigación principal está centrada en técnicas para obtener varios tipos de células sanguíneas a partir de células iPS. Etō y su equipo han logrado desarrollar un método para producir grandes cantidades de plaquetas a partir de células iPS.
Cuando se lesiona la piel o los vasos sanguíneos, las plaquetas bloquean y cubren la herida y desempeñan un papel clave en la detención de la hemorragia. La trombocitopenia es una enfermedad provocada por la deficiencia de plaquetas. Normalmente, el tratamiento más efectivo es la transfusión de un concentrado de plaquetas humanas. Pero las plaquetas pierden fácilmente su actividad vital, y con las técnicas actuales sólo pueden ser preservadas durante cuatro días después de ser extraídas. En algunas zonas la oferta es inferior a la demanda. Otro problema es que con la repetición de transfusiones se producen anticuerpos antiplaquetarios (la mayoría de estos anticuerpos aparecen como respuesta a la presencia de HLA(*1) en el concentrado de plaquetas de donantes). Esto plantea el peligro de que las plaquetas sean rápidamente eliminadas a consecuencia de un rechazo inmunológico.
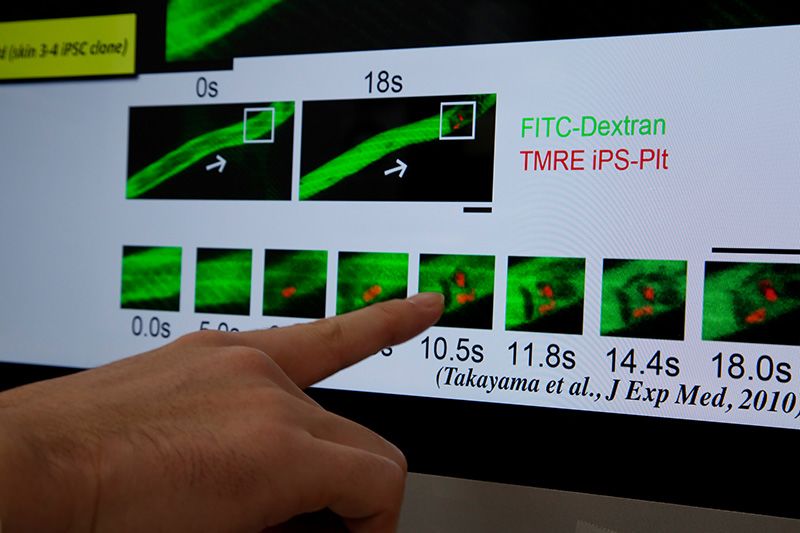 Transfusión de plaquetas fabricadas a partir de células iPS humanas en ratones. Cuando se dañó el endotelio vascular mediante irradiación de láser, estas plaquetas fabricadas a partir de células iPS humanas se agruparon en la herida y formaron coágulos de sangre.
Transfusión de plaquetas fabricadas a partir de células iPS humanas en ratones. Cuando se dañó el endotelio vascular mediante irradiación de láser, estas plaquetas fabricadas a partir de células iPS humanas se agruparon en la herida y formaron coágulos de sangre.
“Si se pudiesen producir plaquetas artificialmente ya no tendríamos que depender de las donaciones de sangre. Eso evitaría problemas de suministro. Y la utilización de plaquetas desarrolladas a partir de células iPS extraídas de las propias células somáticas del paciente evitaría también problemas como el rechazo inmunológico”, afirma el profesor titular Takayama Naoya, quien había trabajado previamente como hematólogo. Este profesor cuenta que su mayor deseo sigue siendo poder obtener plaquetas que “puedan producirse en un tubo de ensayo”.
Takayama lleva muchos años trabajando con células madre pluripontentes y células sanguíneas. Y ahora ha conseguido producir megacariocitos, las células de la médula ósea responsables de la fabricación de las plaquetas, y obtener plaquetas a partir de ellos. En un experimento con ratones a los que se les dañaron los vasos sanguíneos con láseres, las plaquetas por transfusión creadas a partir de células iPS humanas funcionaron normalmente, agrupándose en la herida y formando coágulos de sangre para detener la hemorragia.
Objetivo: aplicaciones clínicas
“Sabemos que existe el riesgo de la formación de tumores con las células iPS”, afirma Takayama. “Pero las plaquetas y los glóbulos rojos no tienen núcleo y por lo tanto no pueden convertirse en tumores. Esto significa que pueden utilizarse con seguridad si se transplantan después de irradiación para impedir la proliferación de otras células. En este sentido, la investigación con células iPS en el campo de la hematología puede estar ya muy cerca de la aplicación clínica”.
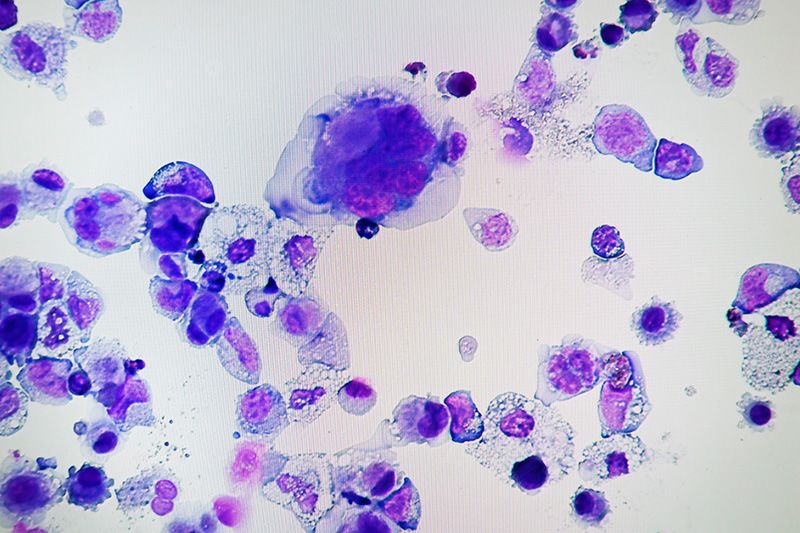 Megacariocitos fabricados a partir de células iPS humanas (Foto: Profesor titular Takayama Naoya, CiRA de la Universidad de Kioto).
Megacariocitos fabricados a partir de células iPS humanas (Foto: Profesor titular Takayama Naoya, CiRA de la Universidad de Kioto).
Se necesitaría un gran número de plaquetas para aplicaciones clínicas reales. Takayama dice que se está trabajando ya para desarrollar una técnica que consiga producir plaquetas estables más eficientemente. En el futuro esperamos que sea posible producir hemocitoblasto, que son la fuente para crear células sanguíneas, a partir de células iPS. Esto sería enormemente beneficioso en el tratamiento de enfermedades de la sangre para las que todavía no existen tratamientos eficaces.
 Las plaquetas también pueden generarse a partir de células ES. Pero la utilización de células iPS permite establecer fácilmente múltiples líneas celulares, de manera que resulta sencillo seleccionar las células más adecuadas para la producción de plaquetas. “Con la información obtenida a partir de células iPS que generan plaquetas de forma eficiente, hemos empezado a producir plaquetas en grandes cantidades”, afirma Takayama.
Las plaquetas también pueden generarse a partir de células ES. Pero la utilización de células iPS permite establecer fácilmente múltiples líneas celulares, de manera que resulta sencillo seleccionar las células más adecuadas para la producción de plaquetas. “Con la información obtenida a partir de células iPS que generan plaquetas de forma eficiente, hemos empezado a producir plaquetas en grandes cantidades”, afirma Takayama.
“En el CiRA, los objetivos de nuestra investigación van desde la investigación básica hasta proyectos como este, que se acercan a la aplicación clínica. Ademas, se investiga la posibilidad de crear una reserva de células iPS para uso médico. Una de las mejores características que tiene el CiRA es que la investigación se lleva a cabo de manera interdisciplinaria, en laboratorio abierto. Yo soy especialista en hematología, pero me inspiro mucho en las ideas que me llegan cada día de los investigadores que trabajan en otros órganos o que llevan a cabo investigaciones fundamentales. Estas ideas me dan pistas para mis propias investigaciones”.
Las técnicas básicas de las células iPS han obtenido patentes en Europa y EE.UU., y también se está avanzando en los preparativos para aplicarlas a usos prácticos. Varios informes científicos han anunciado haber logrado la conversión de células iPS humanas en nervios, miocardio y otros tejidos. Este es un tema que a buen seguro se seguirá con mucho interés en los próximos años.
(Escrito originalmente en japonés por Ushijima Bifue y traducido al español de la versión en inglés. Fotografías de Hans Sautter.)
(*1) ^ HLA: Antígenos leucocitarios humanos (por sus siglas en inglés de Human Leukocyte Antigen). Los HLA se manifiestan en casi todas las células del cuerpo humano y actúan como antígenos de histocompatibilidad (identifican las células del propio cuerpo durante una respuesta del sistema inmunológico). El tipo de HLA juega un importante papel durante el transplante de células. Las células cuyos HLA no coinciden son identificadas como “extrañas” y eliminadas por el sistema inmunológico.
ciencia Universidad de Kioto celulas iPS medicina regenerativa