
Células iPS, la clave de la medicina regenerativa
Ciencia Tecnología- English
- 日本語
- 简体字
- 繁體字
- Français
- Español
- العربية
- Русский
La medicina regenerativa es una disciplina que sigue resultando novedosa, aunque ya lleva años presente en el panorama investigador.
Si tan solo pudiéramos restaurar la función original a los ojos que dejaron de ver la luz, a los brazos y piernas que quedaron inmóviles o al corazón que amenaza con detenerse… Los métodos sustitutorios como la óptica, la ortopedia y los órganos artificiales podrían considerarse, en un sentido amplio, medicina regenerativa. Hace treinta y cinco años un tratamiento para reparar partes del cuerpo mediante el trasplante de células obtuvo una gran resonancia gracias a la creación de células madre embrionarias (células ES, por sus siglas en inglés) a partir de embriones de ratón en 1981. Más tarde, en 1998, se logró crear células ES humanas.
Los aproximadamente 60 billones de células del organismo humano adulto surgen de la división de un solo zigoto. Mientras que las células madre tienen la capacidad de dividirse para crear tanto células idénticas a sí mismas como de otros tipos (diferenciación pluripotencial), los zigotos son un tipo de células madre capaz de formar todas las células que componen el organismo adulto.
Las células ES se forman a partir de embriones en fase primaria, que resultan de seis o siete divisiones celulares del zigoto. Son células madre con capacidad de diferenciación pluripotencial que pueden multiplicarse prácticamente sin límite. Pero, aparte de ser la gran esperanza como células base para la medicina regenerativa, presentan una serie de retos: el desarrollo de una técnica para inducir de forma segura a la diferenciación en las células deseadas, la minimización de la reacción de rechazo del organismo y, como mayor obstáculo, la superación del dilema ético de producir células a partir de zigotos humanos.
Mientras el resto del mundo investigaba cómo inducir las células ES a la diferenciación en otras células del cuerpo, Yamanaka Shin’ya adoptó un enfoque distinto y logró dar con otro tipo de células equiparables a las células ES: las células madre pluripotentes inducidas (iPS).
Las células madre sin dilemas éticos se llevaron el Nobel de 2012
Yamanaka descubrió los llamados factores Yamanaka (Oct3/4, Sox2, Klf4, c-Myc) entre los 24 genes que suelen manifestarse en las células ES. Para crear las células madre pluripotentes inducidas, similares a las ES, Yamanaka utilizó fibroblastos de ratón y transfirió los cuatro factores mencionados al ADN de las células mediante vehículos retrovirales. La i del término célula iPS (del inglés induced pluripotent stem cell) se puso en minúscula a propósito con la esperanza de contagiarse de la suerte del reproductor de música portátil iPod de Apple, que entonces triunfaba en todo el mundo.
La revista estadounidense Cell publicó los pormenores del procedimiento de creación celular y la identidad de los cuatro genes descubiertos por Yamanaka el 25 de agosto de 2006. Pero, para poderlas aplicar a tratamientos en humanos, las células iPS debían obtenerse a partir de células humanas. Pues bien, mientras que para las células ES se tardó diecisiete años en pasar de las células de ratón a las humanas, el profesor Yamanaka logró obtener células iPS humanas en 2007, el año posterior a su creación en ratones.
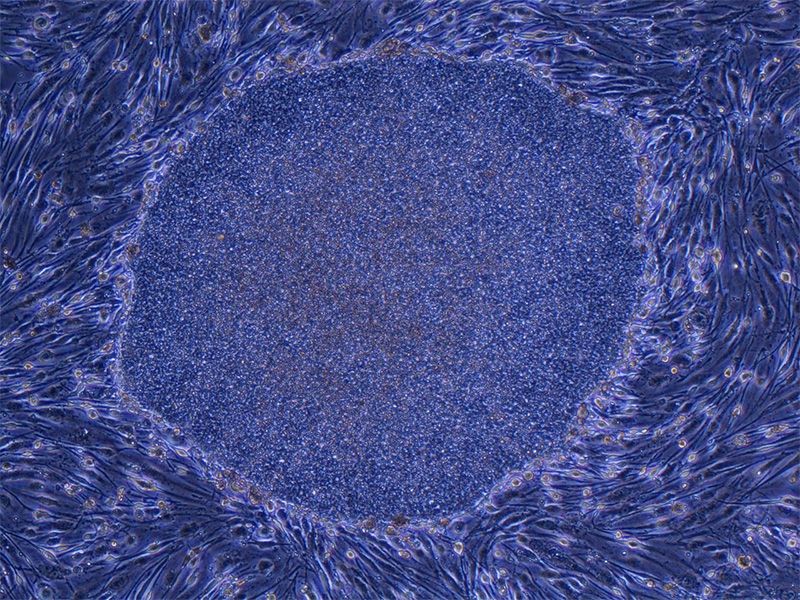 Una colonia de células iPS humanas formada a partir de fibroblastos. La colonia mide aproximadamente 0,5 milímetros de ancho. (Fotografía facilitada por el profesor Yamanaka Shin’ya)
Una colonia de células iPS humanas formada a partir de fibroblastos. La colonia mide aproximadamente 0,5 milímetros de ancho. (Fotografía facilitada por el profesor Yamanaka Shin’ya)
 El profesor Yamanaka Shin’ya en la Universidad de Kioto. Julio de 2016. (Jiji Press)
El profesor Yamanaka Shin’ya en la Universidad de Kioto. Julio de 2016. (Jiji Press)
Las células iPS tenían el potencial de transformar no solo la medicina regenerativa, sino toda la medicina clínica. Por ejemplo, se preveía que comparando las células enfermas de un paciente con sus células iPS regeneradas sería posible dilucidar el mecanismo de la enfermedad, algo que contribuiría a desarrollar fármacos para tratarla. Incluso acérrimos detractores de las células ES por motivos morales como el entonces presidente de Estados Unidos George Bush o el Papa de Roma recibieron con los brazos abiertos la aparición de las iPS. En 2012, aunque el descubrimiento seguía sin haberse podido aplicar para salvar ninguna vida humana, le valió el Premio Nobel de Medicina o Fisiología a Yamanaka.
El descubrimiento de las células iPS humanas representó el pistoletazo de salida en la carrera del desarrollo de la anhelada medicina regenerativa.
El método de preparación inicial presentaba riesgos de cancerización de las células y una eficiencia productiva extremadamente baja. La mejora de la seguridad mediante la modificación del método productivo y los genes utilizados permitió iniciar los estudios clínicos en 2014. El 12 de septiembre, en el Instituto de Investigación e Innovación Biomédica de Kobe, se trasplantó en el ojo de una paciente de 70 años que sufría degeneración macular senil (de tipo exudativo) —una enfermedad ocular intratable— una lámina epitelial del pigmento retiniano originada por células iPS creadas a partir de sus propias células dérmicas.
La investigación fue liderada por Takahashi Masayo, oftalmóloga y jefa de proyecto en el instituto de investigación RIKEN. Como el objetivo que regía el experimento era la evaluación de la seguridad, se proyectó un período de cuatro años para monitorizar el estado de fijación del injerto y la posible presencia de cancerización. Ya han pasado dos años y por el momento no ha ocurrido ninguna irregularidad. No obstante, un segundo experimento previsto para 2015 tuvo que cancelarse al observarse una serie de mutaciones genéticas en las células iPS formadas a partir de tejidos del paciente.
Las claves para evitar el rechazo y la cancerización
La creación de células iPS a partir de células procedentes del propio paciente presenta la ventaja de reducir la reacción de rechazo ante el trasplante. Aun así, para obtener las células iPS a partir de las de la paciente y elaborar la lámina retiniana —efectuando concienzudas comprobaciones de seguridad— en el primer experimento se tardaron once meses, y los costes superaron los cien millones de yenes. Por eso para el siguiente experimento se inducirá a las células epiteliales del pigmento retiniano a la diferenciación en el RIKEN, usando las células iPS del banco del Laboratorio de Investigación de Células iPS de la Universidad de Kioto. Se prevé llevar a cabo el trasplante siguiendo este método en 2017.
Igual que en la sangre existe el tipo sanguíneo, en las células existe el tipo de antígenos leucocitarios humanos (HLA, por sus siglas en inglés). Y al igual que la sangre de tipo O puede transfundirse en cualquier persona, existen ciertas combinaciones de tipo celular que no provocan reacción de rechazo aunque se trasplanten a un receptor distinto del donante. En la Universidad de Kioto están creando un banco de células iPS de tipos HLA que muestran una gran versatilidad de uso.
 Depósito para almacenar las células iPS del Centro para el Tratamiento de Células iPS del Laboratorio de Investigación de Células iPS de la Universidad de Kioto. (Fotografía facilitada por el propio centro)
Depósito para almacenar las células iPS del Centro para el Tratamiento de Células iPS del Laboratorio de Investigación de Células iPS de la Universidad de Kioto. (Fotografía facilitada por el propio centro)
Existen decenas de miles de tipos de HLA distintos. Las personas que heredan el mismo tipo de HLA que sus padres (HLA idéntico) presentan tipos del estilo AA, BB, CC, etc. Trasplantando células de una persona de tipo AA, por ejemplo, a otra de tipo AB o AC, es posible minimizar la reacción de rechazo. Considerando los tipos de HLA más frecuentes entre los japoneses, con 75 personas (tipos) de HLA idéntico se cubriría al 80 % de la población, y con 140 personas, al 90 %. La Universidad de Kioto es perfectamente capaz de crear un banco que incluya muestras de todos los tipos, y para ello está buscando donantes de HLA idéntico a través de bancos de sangre como el del Hospital Universitario de la propia universidad, la Cruz Roja de Japón o el Banco de Sangre de Cordón. Actualmente la universidad está creando células iPS de alta calidad a partir de muestras donadas, y prevé obtener un catálogo que cubra entre el 30 % y el 50 % de la población japonesa para finales de 2017.
El problema de la cancerización de las células, que constituye el mayor reto técnico del proyecto desde su inicio, no ha logrado eliminarse por completo ni alterando el método de producción. Si se logra inducir a todas las células iPS tratadas a diferenciarse en el tipo de células deseado no hay problema; sin embargo, si parte de las células quedan sin diferenciar, existe el riesgo de que se corrompan. La clave del futuro de la medicina regenerativa será hallar un método para garantizar la diferenciación de todas las células o bien para separar las células indeseadas del resto.
Legislando para impulsar la medicina regenerativa
El Gobierno apoya indirectamente la aplicación práctica de los tratamientos con células iPS con medidas como la modificación de la legislación. Gracias a la enmienda realizada a la Ley de Productos Farmacéuticos en noviembre de 2014, la Administración permitió la comercialización provisional —con un período y una aplicación limitados— de productos relacionados con la medicina regenerativa (como las láminas celulares) como productos farmacéuticos una vez se demuestre su seguridad y se presuma su efectividad. Para lograr la certificación para la comercialización regular hay que demostrar la efectividad del producto en un cierto período tras su comercialización y superar una serie de inspecciones. Con esta nueva legislación se estima reducir a 2 o 3 años el período necesario para la certificación de los fármacos, que con la antigua ley llegaba a alargarse más de un decenio.
Aunque la nueva legislación sitúa a Japón en la vanguardia mundial de la medicina regenerativa, ser el primer país del mundo en aprobar sus productos también implica afrontar ciertos riesgos.
Por otro lado, Japón ha establecido limitaciones legales para evitar que tratamientos de medicina regenerativa sin efecto ni seguridad demostrados se distribuyan de forma paralela como tratamientos independientes excluidos del sistema sanitario público.
La investigación de una amplia variedad de tratamiento nuevos
La investigación con células iPS para su aplicación en el tratamiento de problemas como la insuficiencia cardíaca, las lesiones de la médula espinal o la enfermedad de Parkinson avanza a buen ritmo, y ya falta poco para dar el salto de la experimentación con animales a los estudios clínicos con humanos.
Okano Hideyuki, jefe de la Facultad de Medicina de la Universidad de Keiō, está trabajando para la aplicación práctica de un tratamiento para las lesiones de la médula espinal. Como las lesiones medulares, causadas por accidentes o traumatismos, se cronifican en los primeros estadios, no da tiempo a crear células iPS a partir de tejidos del paciente para tratarlas. Ya está en marcha un proyecto para solucionar este problema que prevé inducir a la diferenciación células madre neuronales procedentes del banco de la Universidad de Kioto antes mencionado, y efectuar la primera implantación en un paciente humano en el año fiscal 2017. Más adelante se planea desarrollar el tratamiento para los infartos cerebrales.
Por otro lado, el profesor Sawa Yoshiki de la Universidad de Osaka aspira a desarrollar un tratamiento para la insuficiencia cardíaca que consiste en fijar al corazón una lámina de miocardio creada a partir de células iPS.
El profesor Takahashi Jun de la Universidad de Kioto está desarrollando un método terapéutico para la enfermedad neurológica de Parkinson mediante neuronas fabricantes de dopamina procedentes de células iPS. También colabora con la Cruz Roja de Japón en un proyecto para fabricar plaquetas y glóbulos rojos derivados de células iPS para combatir la falta de donantes de sangre derivada del envejecimiento demográfico. Asimismo tiene entre manos un proyecto para un tratamiento oncológico mediante la activación de inmunocitos contra el cáncer, también basado en la técnica de las células iPS.
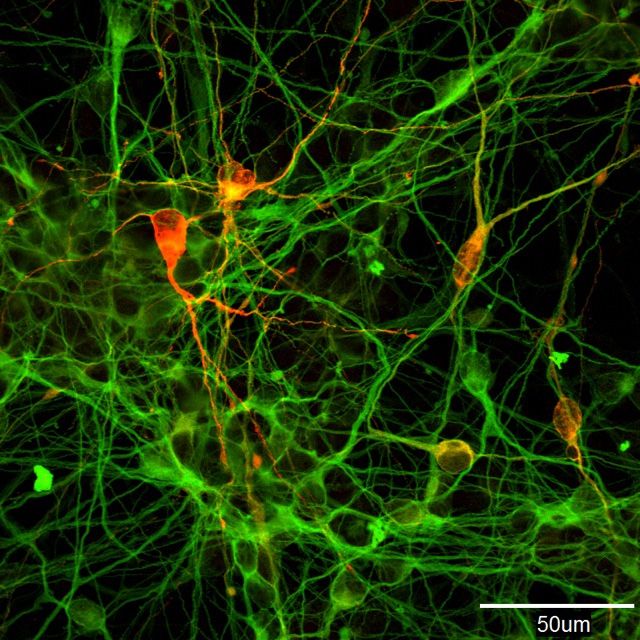 Neuronas fabricantes de dopamina inducidas, creadas a partir de células iPS humanas. (Fotografía de Morizane Asuka, del Laboratorio de Investigación de Células iPS de la Universidad de Kioto)
Neuronas fabricantes de dopamina inducidas, creadas a partir de células iPS humanas. (Fotografía de Morizane Asuka, del Laboratorio de Investigación de Células iPS de la Universidad de Kioto)
Incluso se está investigando para fabricar órganos humanos completos. El profesor Taniguchi Hideki de la Universidad Municipal de Yokohama ha logrado crear un brote hepático induciendo células precursoras (células que componen el organismo en fase intermedia de diferenciación) del hígado procedentes de células iPS.
La aplicación de las células iPS en el desarrollo de nuevos fármacos
La investigación de las células iPS ha generado expectativas en torno a la elaboración de nuevos fármacos desde sus inicios.
Se dice que solo una de cada decenas de miles de sustancias candidatas a fármaco llegan a convertirse en un fármaco viable, y que en la mayoría de los casos el desarrollo acaba suspendiéndose a medio camino por causas como la detección de efectos secundarios graves. Las células iPS podrían servir como herramienta para prever los efectos secundarios de antemano. Por ejemplo, podrían usarse células hepáticas inducidas a partir de células iPS humanas para prever la toxicidad hepática. Incluso la arritmia, un efecto secundario farmacológico potencialmente mortal, puede preverse con células de miocardio inducidas a partir de células iPS.
Las enfermedades intratables son las que levantan más expectativas. En 2012 el Ministerio de Educación, Cultura, Deportes, Ciencia y Tecnología y el Ministerio de Salud, Trabajo y Bienestar lanzaron un proyecto conjunto entre el sector industrial y el académico para la investigación del tratamiento de enfermedades intratables con células iPS. El proyecto consiste en obtener células a partir de muestras de tejidos dérmicos, sangre, etc. donadas por pacientes con enfermedades intratables, usarlas para producir células iPS en cinco centros —incluida la Universidad de Kioto—, inducirlas a diferenciarse en las células de la parte afectada del paciente y así descubrir las características patológicas para finalmente desarrollar fármacos que combatan la enfermedad.
En el proyecto participan siete compañías farmacéuticas que colaboran con 50 equipos de investigación de enfermedades intratables del Ministerio de Salud, Trabajo y Bienestar. La Universidad de Kioto y la Universidad de Keiō han hallado, entre los fármacos ya existentes para otras enfermedades, candidatos para seis afecciones como la fibrodisplasia osificante progresiva, y están llevando a cabo estudios clínicos para lograr su aplicación en la práctica.
Aunque el Gobierno ya destina decenas de miles de millones de yenes al desarrollo de los tratamientos con células iPS, sigue faltando personal investigador preparado. La Sociedad Japonesa de Medicina Regenerativa ha dado un importante impulso a la formación de técnicos para el cultivo y el procesamiento de las células mediante el lanzamiento de un sistema de certificación para otorgar las cualificaciones de médico certificado en tratamientos regenerativos y de técnico de cultivo clínico.
Si bien los estudios clínicos con células iPS llevan ya diez años de historia, todavía queda un largo camino por recorrer para que sus frutos puedan aplicarse a la medicina práctica. Aun así, la comunidad científica mundial que confía en las posibilidades de las células iPS, encabezada por el pionero doctor Yamanaka, avanza incansable en sus investigaciones, haciendo malabarismos para hallar el equilibrio entre la seguridad y la rapidez, entre los riesgos y los beneficios.
Fotografía del encabezado: Un investigador realiza un experimento en la jornada de puertas abiertas del Laboratorio de Investigación de Células iPS de la Universidad de Kioto. (Fotografía facilitada por el propio centro)