
Les cellules souches iPS à l’assaut des maladies incurables
Science Technologie- English
- 日本語
- 简体字
- 繁體字
- Français
- Español
- العربية
- Русский
Depuis 2006, année de la création des premières cellules iPS par le titulaire du prix Nobel Yamanaka Shinya, le potentiel thérapeutique de la nouvelle technologie nourrit les conversations au sein de la communauté médicale. Grâce à la technique mise au point par Yamanaka, des cellules provenant d’un minuscule échantillon de peau ou de sang peuvent être reprogrammées et cultivées en vue de créer de grandes quantités de cellules capables de se différencier et de générer des cellules spécifiques aux tissus tels que ceux dont sont constitués les muscles, les os, le cœur, le foie, les vaisseaux sanguins et les nerfs.
Si l’excitation suscitée par les applications cliniques de cette technologie s’est focalisée sur la médecine générative, Yamanaka, qui dirige quant à lui le Centre de l’Université de Kyoto pour la recherche sur les cellules iPS et leurs applications (le CiRA), s’est rapidement rendu compte du rôle que ces cellules pouvaient jouer dans la mise au point de médicaments. En septembre de cette année, le CiRA a franchi une importante étape en programmant le premier essai clinique mondial pour un médicament potentiel identifié grâce à l’étude et à la sélection des cellules iPS.
Des espoirs pour les patients atteints de maladies rares
Sous la conduite de Toguchida Junya, directeur adjoint du CiRA, les essais vont porter sur l’efficacité d’un médicament existant, déjà approuvé pour d’autres usages, dans le traitement de la fibrodysplasie ossifiante progressive ou FOP. La FOP est une pathologie rare et sérieuse dans laquelle les tissus conjonctifs du corps – muscles, tendons et ligaments – durcissent peu à peu et se transforment en os. Cette ossification, qui commence à l’enfance, provoque une perte de mobilité, ainsi que des difficultés pour manger et respirer, finissant par entraîner la mort. Bien que les scientifiques aient identifié la mutation génétique responsable de cette maladie, il n’existe actuellement aucun soin ni traitement reconnus. La FOP, qui n’affecte qu’une personne sur deux millions à l’échelle mondiale, et environ quatre-vingts patients au Japon, est inscrite sur la liste des maladies réfractaires pouvant faire l’objet d’un financement public au Japon au titre d’un dispositif spécial de soutien à l’étude et au traitement des maladies rares.
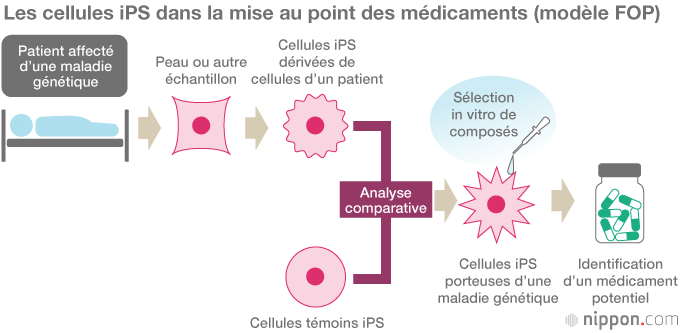
Pour commencer, l’équipe de Toguchida a réussi à reprogrammer des iPSC à partir de cellules de patients atteints de FOP. En les comparant à des cellules témoins iPS exemptes de la mutation FOP, les chercheurs se sont aperçus que les cellules FOP affichaient une capacité beaucoup plus élevée de formation de substance osseuse et de dépôts minéraux in vitro, et ils sont parvenus à identifier des processus essentiels du mécanisme de la formation osseuse anormale. En se servant des cellules iPS pour examiner les effets de quelque 6 800 composés, ils ont découvert que la rapamycine, un médicament immunodépresseur, inhibait l’ostéoformation anormale.
La rapamycine va faire l’objet de tests pour le traitement de la FOP dans les hôpitaux rattachés aux universités de Kyoto, du Kyushu et de Nagoya, ainsi qu’à l’Université de Tokyo. Vingt patients âgés de six ans et plus vont être répartis en deux groupes, dont l’un recevra de la rapamycine pendant six mois.
La rapamycine est aujourd’hui utilisée en Europe pour prévenir les rejets d’organes transplantés. Au Japon, son emploi a été approuvé pour le traitement de la lymphangioléiomyomatose, une autre maladie rare et réfractaire. L’identification de nouvelles applications de la rapamycine offre un exemple de « réorientation médicamenteuse ». Trouver un nouvel usage pour un médicament déjà testé et approuvé réduit grandement les risques d’apparition de graves effets secondaires au cours des essais cliniques. Ce processus est donc beaucoup moins coûteux que la démarche conventionnelle de découverte et de mise au point, puisque les essais d’innocuité et de pharmacocinétique (les effets du médicament sur l’organisme) ont déjà été effectués sur des sujets humains. Il n’en reste pas moins que le coût des essais cliniques se chiffre en dizaines de millions de yens et qu’en outre, lorsqu’il s’agit de pathologies rares comme la FOP, le marché est beaucoup trop petit pour susciter l’intérêt commercial des entreprises pharmaceutiques. Voilà pourquoi l’État finance désormais la recherche et les essais cliniques destinés à tester les médicaments existants en vue de traiter les maladies rares et réfractaires.
Vers une nouvelle ère de production des médicaments
À titre d’exemple d’utilisation de iPSC dérivées de cellules prélevées sur des patients atteints de maladies spécifiques, on peut citer la recherche clinique sur la sclérose latérale amyotrophique (SLA) conduite par le professeur Okano Hideyuki, de l’Université Keiô. En procédant à une sélection basée sur les cellules iPS, l’équipe du professeur Okano a pu identifier un médicament éventuel pour le traitement de cette maladie mortelle, qui détruit progressivement les cellules du nerf moteur du corps et finit par rendre les patients incapables de bouger, de parler ou de respirer. Le début des essais cliniques est prévu pour 2018.
Les chercheurs qui travaillent sous la direction d’Okano se sont également aperçus que la rapamycine inhibe la destruction des cellules de l’oreille interne provoquée par le syndrome de Pendred, une cause fréquente de surdité héréditaire. Et une équipe travaillant sous l’autorité du professeur Fukuda Keiichi, de l’Université Keiô, a découvert qu’un médicament couramment utilisé dans le traitement de l’hypertension artérielle pulmonaire est riche d’espoirs pour la guérison de la cardiomyopathie obstructive, un épaississement héréditaire du muscle cardiaque conduisant à une insuffisance cardiaque.
Au CiRA, l’équipe de recherche du professeur Tsumaki Noriyuki a utilisé la technologie des iPS pour identifier un médicament potentiel pour le traitement de deux maladies rares et réfractaires du squelette. Les chercheurs se sont aperçus que les statines, employées dans le monde entier pour faire baisser les niveaux de cholestérol, avaient un effet positif sur la formation d’os et de cartilage liée à l’achondroplasie, cause de nanisme, et sur la dysplasie thanatophore, une pathologie mortelle du squelette.
De nouvelles perspectives pour la médecine régénérative
La médecine régénérative constitue potentiellement un autre grand champ d’application pour les cellules iPS, à travers l’usage de cellules souches pour remplacer ou régénérer les tissus endommagés. Depuis 2013, le docteur Takahashi Masayo, du Centre Riken pour la biologie du développement, conduit une étude clinique sur l’utilisation de neurones rétiniens différentiés de cellules iPS dans le traitement de la dégénérescence maculaire liée à l’âge, responsable de nombreux cas de cécité chez les personnes âgées. Dans le même temps, et dans le cadre d’un projet mené de concert avec le fabricant d’équipement médical Terumo, le professeur de l’Université d’Osaka Sawa Yoshiki (président de la Société japonaise pour la médecine régénérative) et son équipe se sont lancés dans l’exploration du traitement des patients atteints de déficience cardiaque avancée par la greffe de feuilles cellulaires constituées de myocytes cardiaques (cellules musculaires) dérivés des iPSC. Le début des essais cliniques est prévu pour bientôt.
Le professeur Okano, de l’Université Keiô, qui dirige l’équipe chargée de la mise au point de médicaments contre la SLA, s’apprête à lancer les essais cliniques d’un nouveau procédé de transplantation sans danger de cellules souches neurales dérivées des iPSC dans le corps de patients souffrant de lésions de la moelle épinière. Et, au mois d’août de cette année, une équipe menée par le professeur Takahashi Jun, du CiRA, a annoncé que les tremblements et autres symptômes observés chez des singes atteints de la maladie de Parkinson diminuaient de façon significative après transplantation de neurones obtenus à partir de cellules iPS humaines. La confirmation de l’innocuité et de l’efficacité d’un traitement testé sur des primates constitue en règle générale la dernière étape avant les essais cliniques sur des êtres humains, essais que Takahashi espère commencer au cours de l’année 2018.
Le saint graal de la médecine régénérative basée sur les cellules iPS est la création d’organes humains entiers destinés aux transplantations. Selon les prédictions de Sawa, d’ici trente ans au maximum, la science médicale sera en mesure de produire des cœurs humains fonctionnant grâce au mécanisme relativement simple de la contraction musculaire.
En 2013, le CiRA s’est lancé dans la constitution et la conservation de stocks de cellules iPS destinées à la médecine régénérative. Ces dernières sont reprogrammées à partir des cellules de tissus de donneurs classés selon le type d’antigène des leucocytes humains (HLA), de façon à minimiser les risques de rejet immunologique. Dès la fin de l’exercice budgétaire 2017, le centre aura accumulé suffisamment de cellules iPS différentes pour couvrir 30 % de la population japonaise. La banque a d’ores et déjà fourni des cellules à des équipes de recherche engagées dans le travail mentionné plus haut concernant la dégénérescence maculaire liée à l’âge et l’utilisation des feuilles cellulaires pour régénérer les tissus cardiaques.
La diffusion à grande échelle de l’usage des cellules iPS dans la médecine continue de se heurter à de sérieux obstacles, dont la différenciation au sein de tout l’éventail des tissus humains, l’amélioration de la qualité des cellules et, par-dessus tout, la prévention de la formation de tumeurs provenant des cellules transplantées. En s’appuyant sur les résultats d’analyses séminales obtenus par Yamanaka et d’autres savants qui se situent à l’avant-garde de ce domaine, les spécialistes de la recherche clinique s’efforcent en divers endroits du Japon d’apporter des réponses à ces problèmes et de libérer le potentiel apparemment illimité de la technologie des cellules iPS.
(D’après un original en japonais du 12 octobre 2017. Photo de titre : Le professeur Sawa Yoshiki, de l’Université d’Osaka, annonce un projet d’étude clinique sur l’usage de cellules dérivées des iPSC dans le traitement de l’insuffisance cardiaque, 21 juillet 2017. Jiji Press)