
C мечтой о регенеративной медицине: прогресс исследований iPS-клеток
Наука Технологии- English
- 日本語
- 简体字
- 繁體字
- Français
- Español
- العربية
- Русский
Идея регенеративной медицины одновременно стара и нова. Человек издавна мечтал о возможности вернуть утраченное зрение, силу обездвиженным конечностям, заставить биться с новой силой изношенное сердце... В широком смысле к регенеративной медицине можно отнести очки и протезы, искусственные органы и другие заменяющие средства. Метод клеточной терапии, преследовавший цель решить все эти задачи путём пересадки клеток, привлёк к себе живое внимание 35 лет назад. В 1981 году были получены эмбриональные стволовые клетки (ES-клетки) из эмбриона мышей, а в 1998 году – ES-клетки человека.
Около 60 триллионов клеток взрослого организма человека образуются благодаря многократному делению, началом которого служит одна-единственная оплодотворённая яйцеклетка. Стволовые клетки при делении способны не только воспроизводить сами себя, но и преобразовываться в различные другие типы клеток (то есть обладают плюрипотентностью). Таким образом из оплодотворённой яйцеклетки производятся самые различные клетки, составляющие живой организм.
Эмбриональные стволовые клетки получают из эмбриона ранней стадии – всего после 6-7-кратного деления оплодотворённой яйцеклетки. Эти обладающие свойством плюрипотентности (способностью преобразовываться в разнообразные клетки, формирующие живой организм) клетки можно размножать практически без ограничений. С одной стороны, на ES-клетки возлагают большие надежды как на исходный клеточный материал для регенеративной медицины. В то же время на этом пути остаётся ряд нерешённых задач. Это и технология безопасного стимулирования преобразования в необходимый вид клеток, и технология подавления реакции отторжения, и, наконец, самое серьёзное препятствие: морально-этическая проблема, связанная с тем, что материал производится из оплодотворённых человеческих яйцеклеток.
В обстановке, когда весь мир занимался исследованиями, стремясь заставить эмбриональные стволовые клетки преобразовываться нужным образом в ткани организма, профессор Яманака пошёл совершенно иным путём, который и привёл его к успеху в получении плюрипотентных стволовых клеток, не уступающих эмбриональным стволовым.
Стволовые клетки, не вызывающие сомнений в этичности: Нобелевская премия 2012 года
Из 24-х генов, часто выявляемых в эмбриональных стволовых клетках, были определены четыре, которые впоследствии стали называть «генами Яманаки» (Oct3/4、Sox2、Klf4、c-Myc). При внедрении этих генов в кожные клетки мышей с использованием ретровируса в качестве доставщика генетического кода (вектора) были получены плюрипотентные стволовые клетки, подобные эмбриональным стволовым. В названии клеток – iPS-клетки (induced pluripotent stem cell, «индуцированная плюрипотентная стволовая клетка») – была намеренно использована маленькая буква i по аналогии с получившим тогда распространение по всему миру продуктом фирмы Apple – компактным аудиоплеером iPod.
Детальная техника получения, а также состав четырёх генов были опубликованы в британском научном журнале Cell от 25 августа. Но для того, чтобы использовать iPS-клетки при лечении человека, требовалось получить их из человеческого материала. В случае эмбриональных стволовых клеток для перехода от мышиного материала к человеческому потребовалось 17 лет. В создании iPS-клеток человека профессор Яманака добился успеха уже в 2007 году.
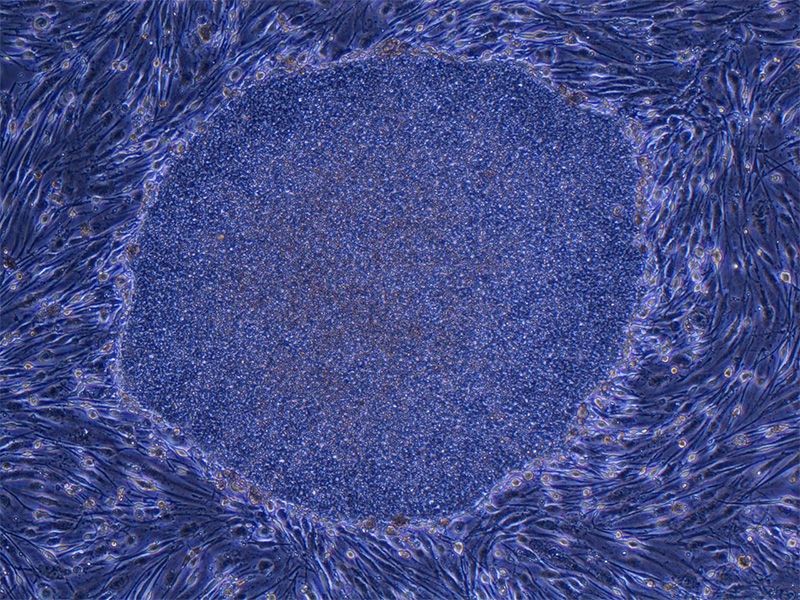 Колония (группа) iPS-клеток человека, выращенных из клеток фибробласта (соединительной ткани). Размер колонии – приблизительно 0,5 мм в поперечнике (фотография предоставлена профессором Яманака Синъя)
Колония (группа) iPS-клеток человека, выращенных из клеток фибробласта (соединительной ткани). Размер колонии – приблизительно 0,5 мм в поперечнике (фотография предоставлена профессором Яманака Синъя)
 Профессор Яманака Синъя отвечает на вопросы на форуме для учащихся полных средних школ, который состоялся 4 ноября 2011 года в Токио (фотография предоставлена Центром исследований iPS-клеток Киотского университета)
Профессор Яманака Синъя отвечает на вопросы на форуме для учащихся полных средних школ, который состоялся 4 ноября 2011 года в Токио (фотография предоставлена Центром исследований iPS-клеток Киотского университета)
В iPS-клетках скрыт потенциал, который способен изменить всю клиническую медицину в целом, не ограничиваясь регенеративной медициной. К примеру, они породили надежду на то, что сопоставление инициализированных iPS-клеток человека с клетками его поражённых заболеванием органов позволит понять механизм развития заболевания и приведёт к созданию лекарства от болезни. Новость об iPS-клетках приветствовали даже такие противники использования эмбриональных стволовых клеток из этических соображений, как президент США Джордж Буш и Папа Римский. Несмотря на то, что на тот момент эти клетки не спасли ни одного больного, в 2012 году профессор Яманака Синъя был удостоен Нобелевской премии по физиологии и медицине.
Открытие iPS-клеток человека дало старт конкуренции на пути к реализации мечты о регенеративной медицине.
Первоначальный метод получения вызывал опасения в связи с превращением клеток в раковые, к тому же эффективность производства была крайне низкой, но благодаря пересмотру техники получения, а также используемых генов, безопасность удалось повысить, и в результате в 2014 году приступили к клиническому испытанию. Двенадцатого сентября в больнице Центра передовой медицины Общества распространения передовой медицины (расположен в городе Кобэ) в глаз 70-летней женщины, страдающей от тяжёлой болезни зрения – дегенерациии (экссудативной) жёлтого пятна – были пересажены ткани пигментного эпителия сетчатки, выращенные с помощью iPS-клеток из кожных клеток самой пациентки.
Исследования возглавил офтальмолог Такахаси Масаё, руководитель проекта Института физико-химических исследований (RIKEN). Основной целью эксперимента была оценка безопасности – учёные намереваются убедиться в приживаемости клеток, а также в наличии либо отсутствии преобразований в раковые клетки более четырёх лет спустя после трансплантации. По прошествии двух лет после операции никаких проблем не возникло. Однако в ходе подготовки к запланированной на 2015 год операции на втором глазу пациентки в ряде iPS-клеток, произведённых из материала пациента, был обнаружен ряд генетических отклонений, в связи с чем от её проведения пришлось отказаться.
Ключ к дальнейшему прогрессу – предотвратить отторжение и превращение в раковые клетки
Преимущество использования материала самого пациента для получения iPS-клеток состоит в том, что этот подход позволяет ослабить реакцию отторжения, от которой зависит судьба трансплантации. Однако для первого пациента процесс получения из клеток пациента iPS-клеток, а также их последующая культивация и производство ткани сетчатки при тщательном контроле безопасности заняли в общей сложности 11 месяцев, а затраты разбухли до сотен миллионов йен. В связи с этим в следующий раз в RIKEN для получения клеток сетчатой оболочки глазного яблока, которые будут пересажены пациенту, рассчитывают воспользоваться запасом iPS-клеток исследовательского центра Киотского университета. С таким подходом возобновить трансплантации планируют в 2017 году.
Подобно группам крови, клетки разделяются по типам, образуя так называемую систему лейкоцитарных антигенов человека (HLA). Подобно тому, как кровь первой группы может быть перелита любому человеку, существуют группы клеток, не вызывающих реакции отторжения при пересадке любому другому человеку. В Киотском университете занимаются созданием запаса таких iPS-клеток высокой универсальности.
 Ёмкости для хранения запаса iPS-клеток в научно-производственном отделе (FiT) Центра исследований iPS-клеток Киотского университета (фотография предоставлена Центром)
Ёмкости для хранения запаса iPS-клеток в научно-производственном отделе (FiT) Центра исследований iPS-клеток Киотского университета (фотография предоставлена Центром)
Даже при предположительном существовании нескольких десятков тысяч типов лейкоцитарных антигенов, унаследовавшие от родителей лейкоцитарные антигены одного типа люди формируют группы по типу АА, BB, CC. И если, к примеру, человеку с типом АА пересадить клетки от человека типа AB или AC, реакция отторжения будет минимальной. Среди японцев наиболее часто встречающиеся 75 типов лейкоцитарных антигенов охватывают 80% населения, а 140 типов покрывают 90% жителей. Такие масштабы позволяют создать в Киотском университете достаточный запас материала. Заручившись сотрудничеством Японского Красного креста, Банка пуповинной крови и других организаций, к людям с определёнными типами лейкоцитарных антигенов обращаются с просьбой стать донорами.
В Киотском университете из полученного таким образом донорского материала изготавливают высококачественные iPS-клетки, пригодные для лечения. Ожидается, что примерно к концу 2017 финансового года будет создан запас, охватывающий по пригодности 30-50% японцев.
С самого начала важнейшей технологической задачей являлось решение проблемы преобразования в раковые клетки. Даже сейчас, после перехода к новым методам получения, нельзя утверждать, что этот риск сведён к нулю. Когда iPS-клетки удаётся стимулировать к полному преобразованию в необходимый клеточный материал, проблем не возникает. Но если в процессе часть клеток остаются необращёнными, они могут привести к развитию опухоли. Ключом к успеху регенеративной медицины служит разработка метода, позволяющего либо обеспечивать полное преобразовние, либо дающего возможность избавляться от материала, не соответствующего поставленной задаче.
Создание юридической базы поможет скорейшей реализации мечты о регенеративной медицине
На пути к практической реализации методов лечения с использованием iPS-клеток государство оказывает поддержку, занимаясь решением задач юридического и прочего характера. В ноябре 2014 года были внесены поправки в прежний Закон о фармацевтике. В отношении клеточных тканей и других «изделий регенеративной медицины» государство подтвердило: в случае, если безопасность проверена, государство разрешает использовать такой материал в качестве медицинского препарата на этапе, когда он считается эффективным, в ограниченные сроки и для ограниченного круга покупателей. Что касается эффективности, то в случае, если по истечении определённого срока продажи она поддаётся проверке, материал получает официальное утверждение после прохождения соответствующих обследований. Если по старому закону для получения разрешения требовалось более десяти лет, то теперь можно ожидать сокращения этого срока до 2-3 лет.
Хотя новое законодательство рассматривают как наиболее передовое на мировом уровне, в то же время можно утверждать, что оно является проявлением решимости идти на определённый риск, поскольку Япония признаёт средства регенеративной медицины прежде, чем остальной мир.
С другой стороны, новый закон принят и в целях защиты пациентов – чтобы предотвратить «серое» (не попадающее под действие системы медицинского страхования) применение на свой страх и риск методов регенеративной медицины, безопасность и эффективность которых ещё не определена.
Широкая сфера продвижения исследований и разработок новых методов лечения
В настоящее время исследования с целью применения iPS-клеток в разнообразных методах лечения сердечной недостаточности, повреждений спинного мозга, болезни Паркинсона и массы других заболеваний приближаются к переходу от испытаний на животных к клиническим испытаниям на людях.
Декан медицинского факультета Университета Кэйо Окано Хидэюки занимается переходом к практической реализации метода лечения повреждений спинного мозга. Поскольку при повреждениях спинного мозга в результате несчастных случаев и травм нарушение быстро приобретает хронический характер, на своевременное получение iPS-клеток из собственных тканей пациента нет времени. Поэтому в дело вступает упомянутый ранее запас iPS-клеток Киотского университета, которые планируется обращать в нервные стволовые клетки. В настоящее время работа продвигается с тем, чтобы выполнить первую трансплантацию человеку уже в 2017 финансовом году. Это открывает перспективу использования такого подхода и при лечении инсультов.
В то же время профессор Осакского университета Сава Ёсиюки ведёт работу, целью которой является лечение сердечной недостаточности методом пересадки к сердцу ткани сердечной мышцы, полученной из iPS-клеток.
В Киотском университете профессор Такахаси Дзюн занимается разработкой метода борьбы с трудноизлечимой болезнью Паркинсона, суть которого состоит в получении вырабатывающих допамин нервных клеток из iPS-клеток. Более того, чтобы решить проблему нехватки доноров крови в стареющем обществе, совместно с Японским обществом Красного креста ведётся работа по получению из iPS-клеток тромбоцитов и эритроцитов. Продвигается и реализация плана создания метода лечения раковых заболеваний посредством активизации клеток иммунной системы с использованием технологии iPS-клеток.
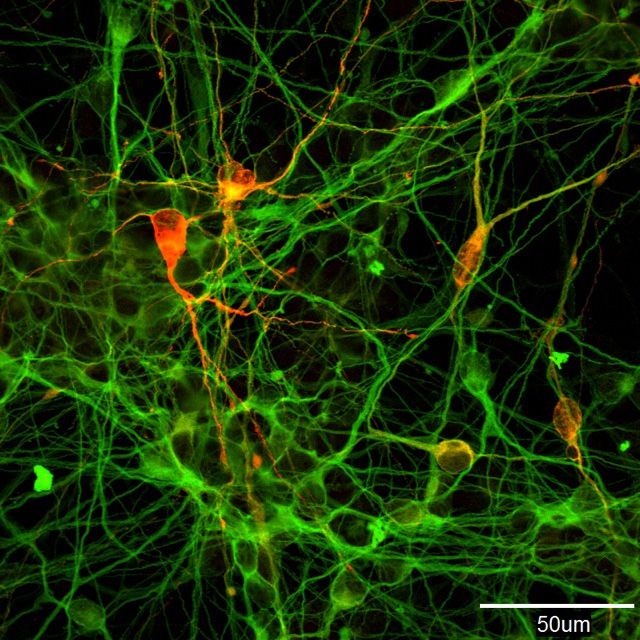 Клетки-производители допамина, полученные посредством инициации преобразования iPS-клеток человека (фотография предоставлена Моридзанэ Асука из Цетра исследований iPS-клеток Киотского университета)
Клетки-производители допамина, полученные посредством инициации преобразования iPS-клеток человека (фотография предоставлена Моридзанэ Асука из Цетра исследований iPS-клеток Киотского университета)
Предпринимаются и попытки создания целых органов. Профессор Танигути Хидэки из Университета города Йокогама далеко продвинулся в создании объёмных элементов печени из клеток-прекурсоров (клеток, которые делятся и превращаются в клетки организма при его формировании).
Прогресс в применении iPS-клеток для создания новых лекарств
Большие надежды с самого начала возлагаются и на второе основное направление использования – создание новых лекарственных препаратов.
Говорят, что доля веществ, которые оказываются пригодны к созданию лекарства, среди прочих подобных составляет не более одного на несколько десятков тысяч, при этом во многих случаях разработчики сталкиваются на полпути с возникновением тяжёлых побочных эффектов, вынуждающих начинать пробы с самого начала. iPS-клетки способны выступать в качестве инструмента, с помощью которого побочные эффекты можно спрогнозировать заранее. К примеру, воспользовавшись клетками печени, полученными путём преобразования iPS-клеток, можно заранее предвидеть печёночную токсичность. Кроме того, среди побочных эффектов следует выделить аритмию, угрожающую самой жизни пациента. Предсказать этот эффект становится возможным с использованием тканей сердечной мышцы, полученных преобразованием iPS-клеток.
Большие ожидания связаны и с областью трудноизлечимых заболеваний. В 2012 году Министерство образования, культуры, спорта, науки и технологий, а также Министерство здравоохранения, труда и благосостояния приступили к реализации научно-производственного проекта, направленного на борьбу с трудноизлечимыми заболеваниями, с использованием iPS-клеток. Он состоит в том, чтобы брать у пациента с трудноизлечимым заболеванием клетки организма – кожи, крови и т. д., получать в пяти центрах совместных исследований, в том числе в Киотском университете, iPS-клетки, изменённые заболеванием, и устанавливать природу заболевания, наблюдая за их преобразованиями в больные ткани, что может привести к созданию лекарства для излечения болезни. В сотрудничестве с 50 группами исследователей трудноизлечимых болезней при Министерстве здравоохранения, труда и социального обеспечения участие в проекте принимают 7 фармацевтических компаний.
Для практической реализации методов лечения с использованием iPS-клеток правительство выделяет десятки миллиардов йен, однако всё ещё остаются задачи в плане подготовки кадров. В научных кругах японской регенеративной медицины начала действовать система лицензирования для «врачей-специалистов регенеративной медицины» и «специалистов по клиническому выращиванию клеточных культур». Таким образом, за подготовку кадров, владеющих технологиями производства и обработки клеточных материалов, взялись всерьёз.
Если уже можно констатировать, что за прошедшее десятилетие удалось приступить к клиническим исследованиям iPS-клеток, вместе с тем необходимо признать, что до того времени, когда ими сможет воспользоваться любой нуждающийся, ещё предстоит пройти долгий путь. Но ученые по всему миру, во главе с пионером в этой области, профессором Яманака Синъя, верят в возможности iPS-клеток и не жалеют усилий в их исследованиях, стремясь сбалансировать скорость и безопасность, риски и выгоды использования.
Фото к заголовку: исследователь ставит опыт в открытой лаборатории Центра исследований iPS-клеток Киотского университета (фотография предоставлена Центром)
(Статья на японском языке опубликована 28 сентября 2016 г.)